Acid cloros
În lumea de astăzi, Acid cloros a devenit un subiect de mare relevanță și interes pentru un număr mare de oameni. De la descoperirea sa și până astăzi, Acid cloros a făcut obiectul multiplelor studii, dezbateri și progrese științifice care au contribuit la extinderea cunoștințelor noastre pe această temă. În acest articol, vom explora diferite aspecte legate de Acid cloros, analizând impactul acestuia asupra societății, evoluția sa în timp și posibilele implicații pe care le are pentru viitor. Printr-o perspectivă multidisciplinară, vom căuta să înțelegem în profunzime tot ceea ce Acid cloros are de oferit și modul în care influența sa se extinde în diferite zone ale vieții noastre de zi cu zi.
| Acid cloros | |
 | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 13898-47-0 |
| ChEMBL | CHEMBL1906899 |
| PubChem CID | 24453 |
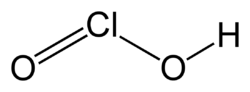
| Formulă chimică | ClHO₂[1] |
| Masă molară | 67,967 u.a.m.[2] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Acidul cloros este un oxoacid al clorului cu formula chimică HClO2 în care atomul central de clor are numărul de oxidare +3.
Acidul cloros se obține prin acțiunea acidului sulfuric asupra cloritului de bariu:
Ba(ClO2)2 + H2SO4 = 2 HClO2 + BaSO4
Acidul cloros se poate obține și prin reducerea dioxidul de clor cu peroxid de hidrogen:
2 Cl2O + H2O2 = 2 HClO2 + O2
Cloritul de sodiu este folosit la decolorarea celulozei și pentru albirea fibrelor naturale (bumbac și in) sau sintetice (poliamidă, poliacrilonitril, poliester etc.). Acesta mai poate fi folosit la dezinfectarea apei din piscine.
Note
- ^ a b „Acid cloros”, Chlorous acid (în engleză), PubChem, accesat în
- ^ „Acid cloros”, Chlorous acid (în engleză), PubChem, accesat în