Dioxid de clor
Astăzi, Dioxid de clor rămâne un subiect relevant și de interes pentru o mare varietate de oameni. Odată cu progresul tehnologiei și globalizarea, Dioxid de clor a devenit un punct central de discuție în diferite domenii. Atât la nivel personal, cât și profesional, oamenii continuă să caute informații, sfaturi și opinii despre Dioxid de clor. Pe măsură ce societatea evoluează, la fel evoluează și felul în care Dioxid de clor ne influențează viețile. Prin urmare, este important să explorăm în detaliu diferitele aspecte legate de Dioxid de clor, pentru a înțelege influența acestuia asupra vieții noastre de zi cu zi și asupra lumii din jurul nostru.
| Dioxid de clor | |
 | |
 | |
 | |
| Nume IUPAC | Dioxid de clor |
|---|---|
| Alte denumiri | Oxid de clor (IV) |
| Identificare | |
| Număr CAS | 10049-04-4 |
| PubChem CID | 24870 |
| Informații generale | |
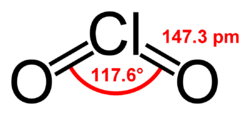
| Formulă chimică | ClO2 |
| Aspect | gaz galben-verzui |
| Masă molară | 67,45 g/mol |
| Proprietăți | |
| Densitate | 2,757 g/dm3 |
| Punct de topire | −59 °C |
| Punct de fierbere | 11 °C |
| Solubilitate în apă | |
| 8 g/dm3 | |
| Presiune de vapori | 1 atm[1] |
| Pericol | |
| Fraze R | R6, R8, R26, R34, R50 |
| Fraze S | (S1/2), S23, S26, S28, S36/37/39, S38, S45, S61 |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Dioxidul de clor este un compus chimic cu formula ClO2. Este o substanță gazoasă de culoare galben-verzuie, iar la temperaturi mai mici de −59 °C are aspect de cristale portocalii. Fiind un oxid al clorului, poate fi folosit ca agent oxidant.[2]
Obținere
În laborator
În laborator, ClO2 poate fi preparat prin oxidarea cloritului de sodiu:[3]
Dioxidul de clor mai poate fi preparat și prin reacția dintre cloratul de potasiu și acidul oxalic:
Referințe
- ^ http://www.cdc.gov/niosh/npg/npgd0116.html Lipsește sau este vid:
|title=(ajutor) - ^ Greenwood, Norman N.; Earnshaw, Alan (). Chemistry of the Elements (ed. 2nd). Oxford: Butterworth-Heinemann. pp. 844–849. ISBN 0080379419.
- ^ Derby, R. I.; Hutchinson, W. S. (). „Chlorine(IV) Oxide”. Inorganic Syntheses. Inorganic Syntheses. IV: 152–158. doi:10.1002/9780470132357.ch51. ISBN 978-0-470-13235-7.








